KHÓA HỌC ONLINE ÔN THI NỘI TRÚ HIỆU QUẢ - GIẢI PHẪU SINH LÝ HÓA SINH SINH HỌC - NỘI KHOA NGOẠI KHOA SẢN KHOA NHI KHOA
DVCSTEM, 12/05/2023
Louis A. Cona, MD
Tế bào gốc trung mô (Mesenchymal stem cells, viết tắt là MSC) là các tế bào gốc trưởng thành có khả năng biệt hóa thành nhiều loại tế bào có nguồn gốc từ trung bì, cho thấy kết quả đầy hứa hẹn trong các nghiên cứu tiền lâm sàng đối với các bệnh khác nhau. Nghiên cứu tiếp tục khám phá tiềm năng của chúng trong y học tái tạo.
MSC là gì?
MSC là các tế bào gốc trưởng thành được phân lập từ các nguồn khác nhau có thể biệt hóa thành các loại tế bào khác. Nguồn của MSC bao gồm tủy xương, chất béo (mô mỡ) và mô dây rốn.
MSC có thể tự làm mới và cũng thể hiện sự biệt hóa đa dòng. Chúng có thể bổ sung số lượng tế bào gốc của một người thông qua cấy ghép, vì chúng có thể tránh được phản ứng tiêu cực từ hệ thống miễn dịch của một người [1].
MSC đã được nghiên cứu rộng rãi về sinh học tế bào độc đáo của chúng, tiềm năng lâm sàng trên phạm vi rộng và là khối xây dựng trung tâm trong lĩnh vực kỹ nghệ mô đang phát triển nhanh chóng [4]. Các nghiên cứu lâm sàng điều tra hiệu quả của MSC trong điều trị bệnh đang ở giai đoạn phát triển sơ bộ, đặc biệt là để tìm hiểu các bệnh tự miễn dịch, bệnh thải ghép so với vật chủ và bệnh ung thư. Hiệp hội Quốc tế về Liệu pháp Tế bào (ISCT) đã đề xuất các tiêu chuẩn để xác định MSC.
Trung mô nghĩa là gì?
Thuật ngữ “trung mô” đề cập đến nguồn gốc phôi thai của các tế bào, cụ thể là các tế bào phát sinh từ lớp mầm trung bì. Lớp mầm trung bì là một trong ba lớp mầm chính hình thành trong giai đoạn đầu của quá trình phát triển phôi thai. Trung bì tạo ra nhiều loại mô liên kết khác nhau, chẳng hạn như cơ, xương, sụn và mỡ, cũng như các tế bào hình thành mạch máu, tế bào máu và hệ thống niệu sinh dục.
Những đặc điểm xác định MSC của con người?
Ủy ban tế bào gốc trung mô và mô của Hiệp hội trị liệu tế bào quốc tế đề xuất các tiêu chuẩn tối thiểu để xác định các MSC của con người.
Mặc dù các tiêu chí để xác định MSC có thể cần phải được điều chỉnh khi xuất hiện kiến thức mới, nhưng người ta tin rằng các tiêu chuẩn tối thiểu do ISCT đề xuất sẽ dẫn đến việc mô tả đặc tính của MSC nhất quán hơn và tạo điều kiện thuận lợi cho sự hợp tác giữa các nhà nghiên cứu về tế bào gốc trung mô.
Hiện tại, nghiên cứu về MSC bị cản trở bởi nhiều phương pháp và cách tiếp cận khác nhau để phân lập, tăng sinh và mô tả đặc điểm của tế bào, gây khó khăn cho việc so sánh và đối chiếu các kết quả nghiên cứu. Các hướng dẫn của ISCT nhằm chuẩn hóa nghiên cứu tế bào gốc trung mô.
Tiềm năng biệt hóa của MSC
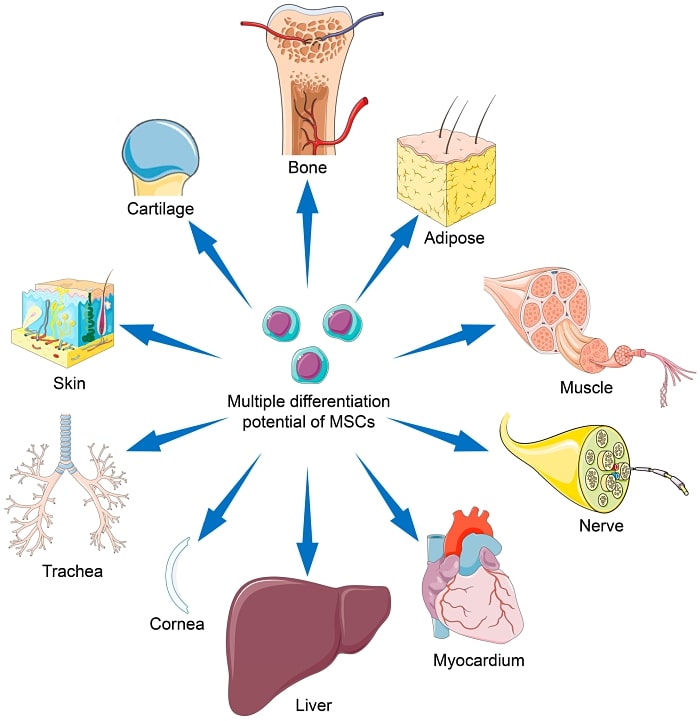
MSC là một loại tế bào gốc trưởng thành có thể biệt hóa thành nhiều loại tế bào khác nhau, bao gồm nguyên bào xương (tế bào xương), sụn (tế bào sụn) và mỡ (tế bào mỡ). MSC của con người cũng có thể biệt hóa thành các loại tế bào khác, chẳng hạn như cơ (tế bào cơ), thần kinh (tế bào thần kinh) và tế bào mô đệm.
Theo một nghiên cứu được bình duyệt công bố trên tạp chí Stem Cell Reviews and Reports (3), các MSC đã được chứng minh là có khả năng biệt hóa thành nhiều loại tế bào khác nhau, bao gồm:
Osteoblasts (tế bào xương)
Chondrocytes (tế bào sụn)
Adipocytes (tế bào mỡ)
Myocytes (tế bào cơ)
Neurocytes (tế bào thần kinh)
Hepatocytes (tế bào gan)
Pancreatic cells (tế bào tụy)
Cardiomyocytes (tế bào cơ tim)
Endothelial cells (tế bào mạch máu)
Epithelial cells (tế bào lót bề mặt)
Trong một nghiên cứu được bình duyệt ngang hàng khác được công bố trên International Journal of Molecular Sciences, các tế bào trung mô có thể biệt hóa thành các tế bào dòng trung mô, bao gồm nguyên bào xương, tế bào mỡ và tế bào sụn là các tế bào có nguồn gốc từ ngoại bì và nội bì, chẳng hạn như tế bào thần kinh và tế bào gan, tương ứng. (4)
Điều quan trọng cần lưu ý là tiềm năng biệt hóa của MSC có thể khác nhau tùy thuộc vào nguồn tế bào gốc, điều kiện tăng sinh và vi môi trường mà chúng được nuôi cấy.
Tiềm năng biệt hóa là gì?
Sự biệt hóa xảy ra khi một tế bào ít chuyên biệt hơn trở thành một loại tế bào chuyên biệt hơn. Trong các tế bào gốc trung mô, sự biệt hóa đề cập đến quá trình tế bào gốc trở thành các loại tế bào cụ thể, chẳng hạn như tế bào cơ, tế bào thần kinh hoặc tế bào xương.
Một sự tương tác phức tạp của các yếu tố di truyền và biểu sinh kiểm soát quá trình biệt hóa. Các yếu tố di truyền bao gồm sự biểu hiện của các yếu tố phiên mã cụ thể và các phân tử tín hiệu, trong khi các yếu tố biểu sinh bao gồm những thay đổi trong quá trình methyl hóa DNA, sửa đổi histone và biểu hiện RNA không mã hóa.
Quá trình biệt hóa có thể chia thành nhiều giai đoạn. Giai đoạn đầu tiên là kích hoạt các gen cụ thể, dẫn đến sự biểu hiện của các yếu tố phiên mã kiểm soát số phận của tế bào. Giai đoạn thứ hai là bắt đầu tăng sinh tế bào và hình thành các loại tế bào cụ thể. Giai đoạn cuối cùng là sự trưởng thành của các tế bào, dẫn đến sự hình thành các tế bào chức năng.
Các yếu tố khác nhau có thể ảnh hưởng đến tiềm năng biệt hóa
Các yếu tố khác nhau, chẳng hạn như môi trường vi mô, sự sẵn có của các yếu tố tăng trưởng và sự hiện diện của các tế bào khác, có thể ảnh hưởng đến quá trình biệt hóa. Ví dụ: các phân tử tín hiệu chuyên biệt, chẳng hạn như protein hình thái xương (BMP) hoặc Wingless-related integration sites (Wnts), có thể thúc đẩy quá trình biệt hóa tế bào gốc thành tế bào xương hoặc tế bào thần kinh tương ứng.
Trong trường hợp MSC hoặc tế bào mô đệm trung mô đa năng, quá trình biệt hóa có thể được tạo ra bởi các tác nhân biệt hóa như các yếu tố tăng trưởng chuyên biệt, hormone hoặc hợp chất hóa học trong môi trường nuôi cấy xác định. Tiềm năng biệt hóa của MSC có thể khác nhau tùy thuộc vào nguồn tế bào, điều kiện tăng sinh và vi môi trường mà chúng được nuôi cấy.
Chức năng của MSC là gì?
Tiềm năng biệt hóa
MSC có nhiều chức năng, bao gồm khả năng biệt hóa thành nhiều loại tế bào khác nhau, chẳng hạn như nguyên bào xương (tế bào xương), sụn (tế bào sụn) và mỡ (tế bào mỡ). Ngoài ra, MSC có thể ức chế phản ứng miễn dịch và thúc đẩy sửa chữa mô.
Đặc tính điều hòa miễn dịch
MSC được biết đến với đặc tính điều hòa miễn dịch, nghĩa là chúng có thể điều chỉnh hoạt động của hệ thống miễn dịch, giảm viêm và ức chế phản ứng miễn dịch. Đặc tính này làm cho chúng trở thành một ứng cử viên đầy hứa hẹn cho các liệu pháp dựa trên tế bào trong các điều kiện khác nhau, chẳng hạn như các bệnh tự miễn, bệnh mô ghép chống lại vật chủ và thải ghép.
Thúc đẩy sửa chữa và tái tạo mô
MSC cũng có thể thúc đẩy quá trình sửa chữa mô bằng cách giải phóng các yếu tố tăng trưởng và cytokine, giúp thu hút các tế bào khác đến vị trí tổn thương. Các yếu tố tăng trưởng và cytokine này cũng có thể thúc đẩy sự hình thành các mạch máu mới cần thiết cho quá trình sửa chữa mô.
MSC cũng đang được đánh giá trong các nghiên cứu lâm sàng và tiền lâm sàng để điều trị các bệnh như viêm xương khớp, bệnh tạo xương không hoàn hảo, bệnh Crohn, bệnh đa xơ cứng, bệnh Parkinson và nhiều bệnh khác.
Điều quan trọng cần lưu ý là mặc dù các MSC đã cho thấy kết quả đầy hứa hẹn trong các nghiên cứu tiền lâm sàng, nhưng vẫn cần nhiều nghiên cứu hơn để hiểu đầy đủ tiềm năng của chúng và phát triển các liệu pháp an toàn và hiệu quả.
MSC được tìm thấy ở đâu?
Có một số nguồn MSC, bao gồm:
Các tế bào có nguồn gốc từ mô dây rốn, cụ thể là Wharton’s Jelly, là những MSC trẻ nhất và sơ khai nhất hiện có. Dây rốn hầu hết bị loại bỏ sau khi sinh, nguồn này không gây hại và sẵn có.
Điều quan trọng cần lưu ý là việc phân lập và tăng sinh MSC từ các nguồn khác nhau có thể khác nhau và có các thuộc tính khác nhau. Ngoài ra, việc phân lập MSC từ một số vị trí, chẳng hạn như máu ngoại vi và dịch khớp, có thể khó khăn hơn và kém hiệu quả hơn so với tủy xương, mô mỡ hoặc MSC có nguồn gốc từ mô dây rốn.
Nhược điểm của MSC là gì?
Mặc dù MSC và tế bào gốc đa năng đã cho thấy kết quả đầy hứa hẹn trong các nghiên cứu tiền lâm sàng, nhưng cũng có một số hạn chế và thách thức liên quan đến việc sử dụng chúng trong nghiên cứu:
MSC so với tế bào gốc tạo máu (HSC)
MSC và tế bào gốc tạo máu (HSC) đều là tế bào gốc trưởng thành nhưng có sự khác biệt rõ rệt.
Điều quan trọng cần lưu ý là MSC và HSC là những loại tế bào phức tạp và vẫn còn nhiều điều cần tìm hiểu về các đặc tính và ứng dụng điều trị tiềm năng của chúng.
MSC có thể được sử dụng cho những bệnh nào?
MSC đã được nghiên cứu cho nhiều ứng dụng điều trị, bao gồm sửa chữa mô, y học tái tạo và liệu pháp dựa trên tế bào cho các tình trạng bệnh khác nhau. Một số bệnh mà MSC đã được nghiên cứu bao gồm:
Điều quan trọng cần lưu ý là mặc dù MSC đã cho thấy kết quả đầy hứa hẹn trong các nghiên cứu tiền lâm sàng, nhưng vẫn cần nhiều nghiên cứu hơn để hiểu đầy đủ tiềm năng của chúng và phát triển các liệu pháp an toàn và hiệu quả. Ngoài ra, việc sử dụng MSC như một liệu pháp vẫn được xem xét. Cộng đồng y tế đã biết đến sự tồn tại của MSC từ cuối thế kỷ 19. Tuy nhiên, chỉ với những tiến bộ gần đây, các bác sĩ mới có thể kích hoạt và bổ sung các tế bào này để điều trị nhiều bệnh lý khác nhau.
Tài liệu tham khảo:
(1) Ullah, I., Subbarao, R. B., & Rho, G. J. (2015, April 28). Human mesenchymal stem cells – current trends and future prospective. Retrieved from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4413017/.
(2) Ding DC, Shyu WC, Lin SZ. Mesenchymal stem cells. Cell Transplant. 2011;20(1):5-14. doi: 10.3727/096368910X. PMID: 21396235.
(3) Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR. Multilineage potential of adult human mesenchymal stem cells. Science. 1999 Apr 2;284(5411):143-7. doi: 10.1126/science.284.5411.143. PMID: 10102814.
(4) Williams AR, Hare JM. Mesenchymal stem cells: biology, pathophysiology, translational findings, and therapeutic implications for cardiac disease. Circ Res. 2011 Sep 30;109(8):923-40. doi: 10.1161/CIRCRESAHA.111.243147. PMID: 21960725; PMCID: PMC3604746.
(5) Mesenchymal Stem Cells: Biology, Pathways, Translations, and Therapeutic Implications” R. Mishra and S.A. Pittenger, International Journal of Molecular Sciences, 2019.
(6) Comparison of bone marrow- and adipose tissue-derived mesenchymal stem cells: a systematic review” by L. Huang, Y. Liu, P. Cui, and L. Li, Stem Cell Reviews and Reports, 2010.
(7) Standardization of mesenchymal stem cell isolation, expansion and characterization” by C.D. Corcione, R. De Bari, and M.L. Lazzari, Journal of Cellular and Molecular Medicine, 2009.
Nguồn: DVCSTEM